Uge 5 - 2016
Vaccination i det midlertidige børnevaccinationsprogram
Vaccination i det midlertidige børnevaccinationsprogram
I EPI-NYT 3/16 er tidligere beskrevet baggrunden for at indføre en midlertidig ændring af børnevaccinationsprogrammet som forventes at være gældende i ét år. Børn, der begynder på børnevaccinationsprogrammet efter forventet levering uge 7/8 af en hexa-valent vaccine Hexyon®, skal vaccineres med denne vaccine, der ud over beskyttelse mod de sædvanlige sygdomme (difteri, stivkrampe, kighoste, polio og Hæmophilus influenzae B-infektion) også beskytter mod hepatitis B. Vaccinen leveres af medicinalfirmaet Sanofi Pasteur MSD.
Ovenstående ændring medfører ikke ændringer i vaccinationstidspunkterne. Lige som DiTeKiPol/Hib-vaccinen gives Hexyon® ved 3, 5 og 12-måneder.
I det følgende beskrives hvilke ydelseskoder, der skal anvendes ved vaccination i det midlertidige program. Sidst i dette EPI-NYT er hyppige spørgsmål søgt besvaret.
Børn som påbegynder vaccination i det midlertidige børnevaccinationsprogram med hexa-valent vaccine
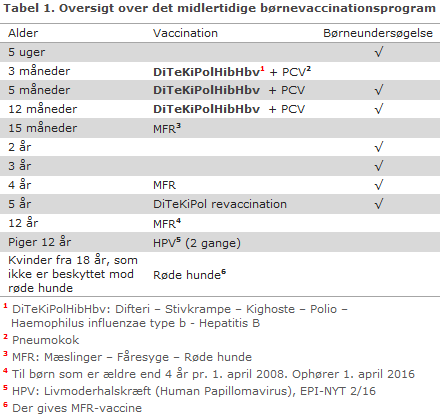
Det midlertidige børnevaccinationsprogram er beskrevet i tabel 1.
Børn der er påbegyndt vaccination med DiTeKiPol/Hib-vaccinen fra SSI (figur 1)
Børn, der er påbegyndt vaccination med SSI’s DiTeKiPol/Hib-vaccine, bør så vidt muligt færdigvaccineres med denne. DiTeKiPol/Hib-vaccinen er p.t. i restordre. Den kan fortsat bestilles fra SSI og forventes leveret uge 6/7. Det er forventningen, at SSI kan levere primærvacciner til færdigvaccination af disse børn. Kun hvis der ikke er flere SSI-vacciner tilgængelige på tidspunktet for vaccination, hverken decentralt eller centralt, skal barnet færdigvaccineres med DiTeKiPolHibHbv-vaccinen, Hexyon® som tredje dosis (og i sjældne tilfælde evt. også som 2. dosis).
Hvis barnet, ved afslutningen af det midlertidige program, har modtaget én eller to DiTeKiPolHibHbv-vacciner, Hexyon®, vil det blive tilbudt gratis at færdiggøre vaccinationsserien mod hepatitis B. Dette vil ske i form af en hepatitis B-vaccine til børn, Engerix-B pæd®, som godt kan gives sammen med andre vacciner, fx MFR-vaccinen. Vaccination af børn under det midlertidige vaccineskift fremgår af figur 1, hvor de relevante ydelseskoder er anført i parentes.

Afregningskoder
Overvågningen af tilslutning til vaccinationsprogrammet tager afsæt i den lovpligtige indberetning af vaccinationer til Det Danske Vaccinationsregister (DDV) via www.fmk-online.dk eller ved integration af DDV i det anvendte elektroniske journalsystem. Afregningerne går primært til Sygesikringen, og importeres herefter i DDV med måneders forsinkelse. Det er meget vigtigt at anvende de korrekte koder for at undgå at der oprettes dubletter, når man allerede har registreret Hexyon® i DDV. Korrekt registrering er også af betydning for overvågningen af eventuelle bivirkninger og for at kunne identificere de børn, der er blevet vaccineret mod hepatitis B.
Til brug for registrering og afregning med Sygesikringen skal der efter aftale mellem Danske Regioner og PLO anvendes følgende koder:
- Til afregning af vaccination med Hexyon® anvendes følgende koder for henholdsvis første (8350), anden (8351) og tredje (8352) dosis. Såfremt et barn har modtaget to doser DiTeKiPolHib-vaccine fra SSI og får tredje dosis med Hexyon® bruges kode 8352.
- For et barn, der har modtaget én dosis Hexyon®, og som færdiggør vaccinationsserien med hepatitis B vaccine, anvendes følgende koder for anden (8353) og tredje (8354) dosis Engerix-B pæd®.
- For et barn, der har fået to Hexyon®, og som færdiggør vaccinationsserien med hepatitis B-vaccine, anvendes kode 8354 til tredje dosis Engerix-B pæd®.
Børn født af hepatitis B-bærermødre (figur 2)
For børn, der er vaccineret mod hepatitis B ved fødslen samt 1 måned gamle, færdiggøres post-ekspositionsprofylakse normalt med Engerix-B pæd®, når børnene er 2 og 12 måneder gamle. Under det midlertidige børnevaccinationsprogram gøres dette med én eller flere doser Hexyon®. Afregning er her en kombination af de normale koder brugt til vaccination af børn født af hepatitis B-bærermødre og de nye midlertidige koder. Se koder ovenfor.
Børn, der er vaccineret to gange med Engerix-B pæd® (ved fødslen samt 1 måned gammel) og ikke er påbegyndt vaccination med DiTeKiPol/Hib, vaccineres tre gange med Hexyon® 3, 5 og 12 måneder gamle, og afregnes med koderne 8350, 8351 og 8352. Der er ikke nogen risiko ved at give i alt fem hepatitis B-holdige vacciner.
Børn, der har fået tre Engerix-B pæd® (ved fødslen samt 1 og 2 måneder gamle) og har fået én DiTeKiPol/Hib-vaccination (3 måneder gammel), vaccineres med 2. DiTeKiPol/Hib, når de er 5 måneder gamle samt med Hexyon® (kode 8352), når de er 12 måneder gamle.
Børn der har fået tre Engerix-B pæd® (ved fødslen samt én og to måneder gamle) og to DiTeKiPol/Hib-vacciner vaccineres med Hexyon® (kode 8352) 12 måneder gamle.
Børn født af mødre med kronisk hepatitis B skal testes for antistof-respons 1-2 måneder efter afsluttet vaccinationsserie med henblik på undersøgelse for anslag for at vurdere om der er indikation for yderligere vaccination. I situationer hvor barnets vaccinationsstatus falder uden for de beskrevne forløb, er sundhedspersonale velkommen til at kontakte Rådgivningsteam i Afdeling for Infektionsepidemiologi telefonisk på 3268 3038 eller skriftligt via epiinfo@ssi.dk.

Om grundvaccinen Hexyon®
Grundvaccinen Hexyon® er produceret af Sanofi Pasteur MSD, godkendt af Det Europæiske Lægemiddelagentur (EMA) og anvendes i andre europæiske lande fx Tyskland og Belgien. Vaccinen er godkendt til at kunne anvendes i et 3, 5 og 12-måneders grundprogram og kan gives samtidig med Prevenar13®. Når Hexyon® og Prevenar13® administreres samtidigt, skal det ske i modsidige ekstremiteter.
Grundvaccinen Hexyon® beskytter mod seks sygdomme: difteri, tetanus, kighoste, polio, hæmophilus influenzae B-infektion og hepatitis B. Antigenerne er adsorberet til aluminium. Hib-komponenten er konjugeret til tetanus-protein. Hepatitis B-overfladeantigen er – som Engerix-B pæd®- fremstillet på gærceller ved rekombinant DNA-teknologi.
Hexyon® leveres i en forfyldt sprøjte, som skal omrystes før brug for at få en homogen, hvidlig uklar suspension. Hexyon® adskiller sig derved fra SSI-grundvaccinen, som leveres som pulver i hætteglas og suspension i fyldt injektionssprøjte, som sammenblandes før injektion. De første Hexyon, som leveres fra SSI, er i tysk pakkemateriale. Disse vacciner udleveres med medfølgende dansk indlægsseddel. Æskerne indeholder ikke kanyler. Fra 2. kvartal i år vil der blive leveret æske i dansk pakkemateriale indeholdende kanyler. For injektionssprøjter uden en monteret nål, skal nålen skrues fast på injektionssprøjten ved at dreje den en kvart omgang.
Vaccinen gives ved intramuskulær injektion.
Minimumsintervallet mellem 1. og 2. dosis er 2 måneder (mod normalt én måned) og mellem 2. og 3. dosis er det 6 måneder. Efter grundvaccination med tre doser skal der som hidtil gives en DiTeKiPol Booster i 5-års-alderen.
Tre doser hepatitis B-holdig vaccine er fuldt tilstrækkelig hos immunkompetente børn, og børn som ikke er født af hepatitis B bærer-mødre. Det er ikke nødvendigt at antistofteste børn der ikke er født af hepatitis B bærer-mødre, EPI-NYT 11/13. Beskyttelsen antages at være livslang. Hos individer med kronisk nyresvigt ses et nedsat hepatitis B-vaccinerespons, og administration af yderligere doser hepatitis B-vaccine skal overvejes ud fra antistofniveauet for hepatitis B-virus overfladeantigen (anti-HBsAg).
Bivirkninger
Bivirkningsmønstret ved Hexyon® adskiller sig ikke væsentligt fra bivirkningsmønstret ved SSI’s grundvaccine. Meget almindelige (≥ 1/10) bivirkninger er appetitløshed, opkastning, gråd, irritabilitet, døsighed, feber ≥ 38 grader, lokal hævelse, smerte og rødme på injektionsstedet. Almindelige (≥ 1/100 til <1/10) bivirkninger er diarre, induration på injektionsstedet og unormal gråd.
Der blev observeret lidt højere reaktogenicitet efter den første dosis i forhold til efterfølgende doser. Der kan forekomme en klinisk påvirkning af antistofrespons på Hexyon® ved samtidig varicellavaccination, og disse vacciner må derfor ikke administreres samtidigt. For oplysning om mere sjældne bivirkninger, kontraindikationer (som bl.a. omfatter overfølsomhed for neomycin og polymyxin B) og særlige advarsler og forsigtighedsregler vedrørende brugen henvises til produktresumé for vaccinen, som kan findes på www.ema.europa.eu.
Indlægssedler for Hexyon® udsendes fra SSI sammen med vaccinen, og kan downloades fra www.indlaegsseddel.dk, inden udlevering startes.
Anmeldelse af bivirkninger – skærpet indberetningspligt
Idet vaccinen ikke tidligere har været anvendt i det danske børnevaccinationsprogram, har Lægemiddelstyrelsen besluttet, at Hexyon® underlægges skærpet indberetningspligt, som indebærer, at læger har pligt til at indberette alle formodede bivirkninger hos personer, som de har i behandling.
Alvorlige bivirkninger skal indberettes til Lægemiddelstyrelsen senest 15 dage efter, at lægen har fået formodning herom, og kan anmeldes via www.meldenbivirkning.dk.
Bestilling/levering
Hexyon® kan bestilles via:
SSI vnr. 97793 DTaP-IPV-HBV-Hib, 10x1 dosis
SSI vnr. 97794 DTaP-IPV-HBV-Hib, 1x1 dosis
Bemærk, at æskerne leveres i tysk pakkemateriale uden medfølgende kanyle. Vaccinen kan bestilles via Blanket 6 på http://www.ssi.dk/Bestil/Blanket6.aspx eller ved henvendelse til Ordremodtagelsen, ordre@ssi.dk eller på telefon 3268 3111.
Vaccinerne leveres på sædvanlig leveringsdag, så snart vaccinerne er kommet på SSI’s varelager, hvilket forventes at ske i uge 7/8.
Spørgsmål og svar
Her kan findes spørgsmål og svar om den midlertidige ændring i det danske børnevaccinationsprogram.
Børn, som er påbegyndt børnevaccinationsprogrammet i udlandet med andre grundvacciner
Børn som er vaccineret i udlandet og som skal vaccineres svarende til det danske vaccinationsprogram, vaccineres videre i forhold til retningslinjer beskrevet i EPI-NYT 5a/15. Dog gælder for Hexyon®, at minimumsintervallet mellem første og anden dosis er to måneder og ikke én måned som for DiTeKiPol/Hib.
Børn over 24 måneder, som endnu ikke er begyndt i børnevaccinationsprogrammet eller ikke er færdige med grundvaccinationer
Der er ikke gennemført kliniske studier hos børn over 2 år med Hexyon®. Denne vaccine har været godkendt af Det Europæiske Lægemiddelagentur siden april 2013 og anvendes i Vesteuropa primært i Tyskland og Belgien. På verdensplan er der givet over 3 millioner doser af denne vaccine. Hexyon®-vaccinen er baseret på en velkendt vaccine fra samme producent, Pentavac®, som har fået tilføjet en Hepatitis B-vaccinekomponent.
Pentavac® er givet i over 160 millioner doser på verdensplan og anvendes blandt andet i Sverige. Hepatitis B-vaccinekomponenten er fundet at være effektiv også for teenagere og voksne. En lignende fire-valent DiTeKiPol-vaccine, Tetravac®, har været anvendt som førskole- og teenage-booster i blandt andet Frankrig. Det vurderes, at så længe det midlertidige vaccinationsprogram i Danmark er i brug, kan Hexyon® anvendes til tilpasning af børn i alderen 2-10 år, EPI-NYT 5a/15. Dog gælder det for Hexyon®, at minimumsintervallet mellem første og anden dosis er to måneder og ikke én måned som for DiTeKiPol/Hib.
Hvad er forskellen mellem DiTeKiPol/Hib og Hexyon®?
DiTeKiPol/Hib-grundvaccinen beskytter mod difteri, stivkrampe, kighoste, polio og hæmophilus influenzae B-infektion. Hexyon®, som nu midlertidigt indgår i børnevaccinationsprogrammet, beskytter mod de samme sygdomme, men giver også beskyttelse mod hepatitis B.
Hvorfor vaccineres børn i Danmark ikke rutinemæssigt mod hepatitis B?
Der vaccineres i dag ikke mod hepatitis B i det danske program grundet generel lav risiko for smitte blandt danske børn. I mange mellem- og sydeuropæiske lande indgår hepatitis B i de nationale programmer, og det anbefales også globalt af WHO. I Danmark har man i stedet valgt en strategi med fokus på vaccination af risikogrupper fx børn født af mødre med hepatitis B, som identificeres via den systematiske screening af gravide.
Skal børn, som ikke er fuldt vaccineret med Hexyon®, selv betale for supplerende doser af Engerix B for at gøre Hepatitis B-vaccinationsserien færdig?
Nej. Hvis det - på grund af mangelsituationen - bliver nødvendigt at færdigvaccinere børn, som er påbegyndt vaccination med SSI’s vaccine, med Hexyon® vil disse børn efterfølgende blive tilbudt vederlagsfri Engerix-B pæd®-vaccination for at fuldføre vaccinationsserien mod hepatitis B.
Er beskyttelsen mod Hepatitis B lige god, om man får den som enkelkomponent-vaccine eller som en del af Hexyon®?
Ja. Studier har vist, at antistofniveauet hos børn, som var vaccineret med Hexyon® ikke var forskellig fra, hvad der blev set i en parallel gruppe, som i stedet fik enkelkomponent hepatitis B-vaccine og en pentavalent DiTeKiPolHib-vaccine.
Hvordan afregner jeg de midlertidigt anvendte vacciner med Sygesikringen?
Under det midlertidige vaccineskift er der indført en række midlertidige afregningskoder; se de afsnit som beskriver vaccination i det midlertidige vaccinationsprogram i nærværende EPI-NYT.
Vaccinationskortet passer ikke med Hexyon®-vaccinen?
De vaccinationskort, som udleveres til forældrene, vil ikke blive trykt om i forbindelse med det midlertidige vaccineskift. I tekstfeltet over DiTeKiPol/Hib må den, som vaccinerer, skrive, at det er Hexyon® der gives, samt notere batch-nummer for denne.
Hvor længe er man beskyttet efter endt grundvaccination?
Efter de tre vaccinationer er der god beskyttelse mod difteri, stivkrampe, kighoste og polio, indtil barnet er 5-6 år.
Der revaccineres i femårsalderen mod difteri, stivkrampe, kighoste og polio. Barnet vil herefter være beskyttet mod difteri og stivkrampe i yderligere 10 år.
Beskyttelsens varighed mod kighoste er formentlig 5-10 år. Beskyttelsen mod polio anses for at være livslang.
Efter tre vaccinationer mod hepatitis B regnes børnene for at være livslangt beskyttede, og der revaccineres ikke.
Hvordan kan det være, at nogen børn får kighoste trods vaccination mod kighoste?
Beskyttelsen mod kighoste stiger markant, jo flere af de tre vaccinedoser barnet har modtaget, hvorfor det er vigtigt at holde de planlagte vaccinationstidspunkter ved 3 og 5 og 12 måneder. Kighostevaccinekomponenten er ikke 100 procent effektiv, og det er derfor forventeligt at se kighoste blandt fuldt vaccinerede børn under to år. Kighoste kan også ses hos fuldt vaccinerede større børn, da beskyttelsens varighed er begrænset til 5-10 år.
Der står på indlægssedlen, at vaccinen ikke må gives, hvis barnet har haft problemer med nervesystemet inden for syv dage efter at være blevet vaccineret med vaccine mod kighoste. Betyder det en ændring i forhold til tidligere praksis?
Nej, der har også tidligere med DiTeKiPol/Hib-vaccinen været en forsigtighedsregel i forhold til børn med fremadskridende neurologiske sygdomme. Disse bør ikke vaccineres med kighosteholdig vaccine. Dette gælder også, hvis der tidligere har været alvorlige reaktioner på vaccination.
Må man vaccinere et barn, der har feber?
I tilfælde af akut sygdom med høj feber bør vaccination udskydes. Milde infektioner som almindelig forkølelse og let feber op til 38 °C giver ikke anledning til at udskyde vaccination. Børn, der har en sygdomstilstand i mulig udvikling eller under udredning, bør ikke vaccineres, før tilstanden er stationær og diagnostisk afklaret.
Kan man nøjes med en halv vaccinedosis for at undgå bivirkninger fx hos et meget lille barn?
Nej, der skal altid gives en fuld dosis for at opnå et tilstrækkeligt immunsvar og dermed beskyttelse. En reduceret dosis medfører stor risiko for ingen beskyttelse overhovedet.
(P. Valentiner-Branth, L.K. Knudsen, P.H. Andersen, Afdeling for Infektionsepidemiologi)
3. februar 2016