Uge 33 - 2014
Ebola-udbrud i Vestafrika
Ny vaccine mod meningokoksygdom gruppe B
Vaccinedag på SSI d. 23. september 2014
Vaccine mod helvedesild er nu tilgængelig
Ebola-udbrud i Vestafrika
I slutningen af marts 2014 blev der rapporteret udbrud af ebola-blødningsfeber i det vestafrikanske land Guinea. Udbruddet har siden spredt sig til nabolandene Liberia og Sierra Leone, og i de sidste uger er der også set få tilfælde i Nigeria. Her er der dog endnu ikke tegn til smittespredning i samfundet.
Ifølge Verdenssundhedsorganisationen WHO er der pr. 12. august kendskab til 1.848 tilfælde fra de fire lande, heraf er ca. 1.013 døde. Der er tale om det hidtil største udbrud af ebolavirus, og WHO har den 8. august erklæret udbruddet for en folkesundhedsmæssig krisesituation af international betydning (Public Health Emergency of International Concern, PHEIC). Denne erklæring var begrundet i, at der er tale om et stort udbrud af en alvorlig sygdom, der er risiko for international spredning, og der er behov for en international koordineret indsats for at begrænse smittespredningen. WHO har udstedt en række anbefalinger for at begrænse udbruddet. Se WHOs anbefalinger. Alle verdens lande har forpligtet sig til at følge disse anbefalinger, da de har tilsluttet sig tilsluttet sig International Health Regulations (IHR, Det internationale sundhedsregulativ).
Ebola-blødningsfeber er en meget alvorlig virusinfektion med en dødelighed på 50-90 %. Sygdommen begynder pludseligt med feber, muskelømhed, almen træthed, hovedpine og halssmerter. Herefter følger opkastninger, diarré, udslæt og påvirket funktion af lever og nyrer. I nogle tilfælde optræder kraftige blødninger fra indre og ydre kropsåbninger, og sygdommen kan udvikle sig til egentligt multiorgansvigt. Sygdommen smitter kun ved kontakt med væsker og sekreter så som blod, opkast, afføring eller sæd fra syge mennesker. Inkubationstiden er 4-10 dage men kan variere fra 2-21 dage. Patienter er først smitsomme fra symptomdebut, derfor ses de fleste tilfælde blandt sundhedsarbejdere, der ikke bærer værnemidler, pårørende, der har haft tæt kontakt med patienter, eller personer der har deltaget i begravelsesceremonier, fx ved at gøre et lig i stand. Der findes ingen vaccine eller specifik behandling, men forsøgsmedicin i form af monoklonalt antistof mod Zaire-ebolavirus er forsøgt med særlig tilladelse i enkelte tilfælde.
Det er første gang, at der har været udbrud med ebolavirus i Vestafrika. WHO, Læger uden Grænser, Røde Kors og andre internationale organisationer bistår de lokale sundhedsmyndigheder med at kontrollere udbruddet ved at isolere og behandle de syge og monitorere kontakter til syge i inkubationstiden, som er op til 21 dage. Selve overvågning af ebolasygdom og adgangen til diagnostisk undersøgelse for ebola er også blevet styrket i regionen, ligesom der er fokus på oplysning af borgere og uddannelse af sundhedspersonale. På trods af disse initiativer er håndteringen af udbruddet en stor udfordring på grund af stor geografiske spredning af sygdomstilfældene, stor mobilitet at befolkningen på tværs af grænser, skrøbelige sundhedssystemer uden tidligere erfaring med ebolaudbrud og mangel på ressourcer og faciliteter til isolation og kontaktopsporing. Herudover har der været udfordringer med manglende forståelse for sygdommen i befolkningen og mistillid til staten, internationale organisationer og det etablerede sundhedsvæsen.
Ifølge den seneste risikovurdering fra det europæiske Center for Disease Prevention and Control (ECDC) kan der optræde rejse-associerede tilfælde med ebola i Europa, men risikoen for smittespredning i Europa anses for lav. Dette skyldes, at både smitteberedskab og sundhedsvæsen i Europa har en højere standard end de berørte afrikanske lande.
Udenrigsministeriet har pr. 8. august frarådet ikke-nødvendige rejser til Guinea, Liberia og Sierra Leone. Dette skyldes blandt andet, at sundhedsvæsenet i disse lande er under så stort pres på grund af ebolaudbruddet, at adgang til behandling for andre sygdomme kan påvirkes. Herudover har både Liberia og Guinea lukket de fleste grænseovergange til og fra landet, og flere flyselskaber har suspenderet flyrejser til landene. Se Udenrigsministeriets rejsevejledning.
Der er fortsat ingen WHO-restriktioner for rejser i de pågældende lande, og risikoen for ebola på rejse anses for lav, hvis man overholder forholdsregler for at mindske risikoen, som fx at undgå kontakt med kropsvæsker fra syge personer. Risikoen er større ved kontakt med sundhedsklinikker, hospitaler o.lign. Se alle rejseanbefalingerne på www.ssi.dk.
Generelt anbefales alle rejsende fra Afrika, der får feber opstået under eller efter rejsen, at kontakte læge. Baggrunden for dette er bl.a. at udelukke malaria eller andre alvorlige infektionssygdomme. Ved kontakt med lægen bør borgere oplyse om symptomer, rejsested og eventuel smitterisiko.
Sundhedsstyrelsen har den 8. august udsendt Retningslinjer for håndtering af ebolavirus sygdom (EVD). Retningslinjerne er målrettet praktiserende læger, lægevagtsklinikker, akutmodtagelser, infektionsmedicinske afdelinger samt ambulancepersonale og lufthavne m.v.
For mere information om udbruddet, rejseanbefalinger, meldepligt og diagnostik se www.ssi.dk.
(T.G. Krause, Afdeling for Infektionsepidemiologi)
Ny vaccine mod meningokoksygdom gruppe B
En ny vaccine, Bexsero®, er godkendt til forebyggelse af infektion med Neisseria meningitidis (meningokokker) af gruppe B. Denne vaccine vil fremover blive tilbudt som postekspositionsprofylaktisk vaccine til personer, som har været nære kontakter til en person med gruppe B meningokoksygdom, men den kan også rekvireres fra SSI til andre patientgrupper.
Bexsero® er en multikomponent proteinvaccine som indeholder tre meningokokproteiner: NHBA (Neisseria heparinbindende antigen), NadA (Neisserial adhesin A) og fHbp (faktor H-bindende protein) samt meningokok gruppe B ydre membran vesikler (Outer Membrane Vesicles).
Vaccineeffektiviteten er skønnet ved, at undersøge induktionen af serum-baktericidt antistofrespons mod hvert af vaccineantigenerne. Det vurderes, at Bexsero® vil kunne forebygge 78 % af alle tilfælde af gruppe B meningokoksygdom i Europa (95 % konfidensgrænser 63-90 %). Virkningen af Bexsero® er ikke blevet evalueret ved kliniske forsøg.
Bexsero® er godkendt til spædbørn fra 2-måneders-alder og til voksne.
Vaccinationsprogram
Antal doser til primærimmunisering er aldersafhængig, se tabel 1.
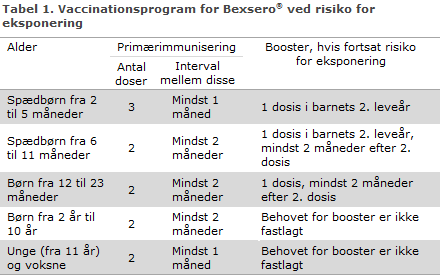
Der foreligger ikke data for effekten af vaccinen for voksne over 50 år eller for patienter med kroniske medicinske tilstande eller svækket immunforsvar. Det vurderes, at der også i disse grupper bør gives to doser med mindst 1 måneds interval. Behovet for booster er ikke fastlagt.
De mest almindelige bivirkninger i de kliniske forsøg hos spædbørn og børn under 10 år var ømhed og rødme på injektionsstedet, feber > 38 °C, irritabilitet, spiseforstyrrelser, søvnighed, usædvanlig gråd, diarré, opkastning og udslæt. Såfremt Bexsero® blev givet som den eneste vaccine, var hyppigheden af feber den samme som ved rutinemæssige børnevaccinationer. Profylaktisk brug af paracetamol nedsatte forekomst og sværhedsgrad af feber uden påvirkning af immunogeniciteten af Bexsero®. De mest almindelige lokale og systemiske observerede bivirkninger hos unge fra 11 år og voksne var smerte på injektionsstedet, utilpashed, hovedpine, kvalme samt muskel- og led-ømhed. Se produktresumé her.
For nyregistrerede lægemidler gælder, at alle observerede eller mistænkte bivirkninger skal anmeldes til Sundhedsstyrelsen i to år efter, at der er givet markedsføringstilladelse. Denne er givet 14. januar 2013.
Personkredsen, der skal tilbydes postekspositionsprofylakse, er som oftest nære kontakter til en person med meningokoksygdom, og fastlægges af embedslægen. Vaccine til nære kontakter kan rekvireres ved kontakt til Afdeling for Infektionsepidemiologi, Statens Serum Institut.
Da Bexsero® ikke er markedsført i Danmark, skal der søges udleveringstilladelse til vaccinen hos Sundhedsstyrelsen. Det er muligt at søge udleveringstilladelse til en enkelt patient (enkelt tilladelse) eller til flere patienter (generel tilladelse). Såfremt Bexsero® rekvireres af anden årsag, skal vaccinen bestilles direkte i ordremodtagelsen, SSI. Kopi af udleveringstilladelsen skal i alle tilfælde sendes til ordremodtagelsen ordre@ssi.dk, før udlevering kan finde sted.
(C.H. Suppli og P. Valentiner-Branth, Afdeling for Infektionsepidemiologi)
Vaccinedag på SSI d. 23. september 2014
SSI inviterer praktiserende læger til en undervisningsdag med fokus på børnevaccinationsprogrammet. Der vil være indlæg fra Afdeling for Infektionsepidemiologi, Sundhedsstyrelsen og WHO og rig mulighed for at stille spørgsmål og dele erfaringer fra praksis.
Se programmet og hvordan man tilmelder sig.
(Afdeling for Infektionsepidemiologi)
Vaccine mod helvedesild er nu tilgængelig
En vaccine mod helvedesild (Zostavax®) blev registreret allerede i 2006, EPI-NYT 26/08, men pga. begrænset produktionskapacitet og prioritering af særlige lande har vaccinen ikke været leveret til det danske marked før nu.
Vaccinen er godkendt til forebyggelse af herpes zoster (”zoster” eller helvedesild) og herpes zoster-relateret postherpetisk neuralgi til patienter i alderen 50 år og derover.
Vaccinen leveres som pulver og solvens til injektionsvæske som suspension i forfyldt injektionssprøjte. Før injektion skal pulveret rekonstitueres i suspensionen, hvorved vaccinen bliver til en let sløret til gennemskinnelig, råhvid til bleggul væske.
Vaccinen indeholder levende svækket varicella zoster virus (Oka/Merck-stamme) produceret i humane diploide celler. Vaccinen er i princippet den samme, som den der anvendes mod skoldkopper, men antigenindholdet er ca. 14 gange højere.
Vaccination gives subkutant som en enkelt dosis (0,65 ml), helst i deltoidea-området. Vaccinen kan gives samtidig med inaktiveret influenzavaccine som separate injektioner og på et andet sted på kroppen. Vaccinen bør ikke indgives samtidig med 23-valent pneumokokvaccine, da samtidig brug i et klinisk studie har resulteret i reduceret immunogenicitet af Zostavax®.
Bivirkninger
Den generelle sikkerhed af Zostavax® er blevet vurderet i kliniske studier med flere end 32.000 voksne. I produktresuméet indgår desuden bivirkninger rapporteret efter markedsføring. For disse vil hyppighed ikke altid være kendt.
De hyppigste bivirkninger er almene symptomer og reaktioner på injektionsstedet som erytem, smerte/ømhed, hævelse og kløe (> 10 %). Hovedpine, lokalt hæmatom, varmefornemmelse og induration er også almindelige bivirkninger (1-10 %). For øvrige bivirkninger henvises til produktresuméet.
For oplysning om kontraindikationer samt forhold omkring fertilitet, graviditet og amning henvises til produktresuméet. Da Zostavax® kun bør gives til personer over 50 år, vil vaccination af gravide som udgangspunkt ikke forekomme.
Vaccineeffekt
Vaccinens effekt er vist i en række studier, som dannede grundlag for registrering samt en række opfølgende studier, bl.a. for at vurdere langtidseffekten. Vaccinen er ikke undersøgt på personer med svækket immunitet.
I de primære effektstudier blandt personer over 60 år var vaccinen 51 % effektiv mod herpes zoster samt 67 % effektiv mod postherpetisk neuralgi efter 3 års opfølgning.
I et opfølgende korttidseffektstudie blandt personer, der var placebovaccinerede 4-7 år tidligere og med en gennemsnitlig kontrolperiode på 1,2 år, var den estimerede vaccineeffekt 40 % mod herpes zoster og 60 % (ikke statistisk signifikant) mod postherpetisk neuralgi. Den gennemsnitlige alder i studiepopulationen var 73,3 år.
I et opfølgende langtidseffektstudie af personer, som tidligere var vaccineret i et primært effektstudie 7-10 år tidligere og med en gennemsnitlig kontrolperiode på 3,9 år, var den estimerede vaccineeffekt 21 % mod herpes zoster og 35 % mod postherpetisk neuralgi. Den gennemsnitlige alder i studiepopulationen var 74,5 år.
Data fra de kliniske studier viser altså, at vaccinens effekt aftager over tid. Behov og tidspunkt for revaccination er endnu ikke fastlagt.
For patienter i fast behandling med systemisk kortikosteroid op til 20 mg/døgn i mindst 2 uger før vaccination og i mindst 6 uger efter denne, giver Zostavax® en geometrisk middel antistof-titerstigning på 2,3 gange sammenlignet med en stigning på 1,1 gange i placebogruppen, hvilket er på niveau med titerstigning hos personer som ikke er i behandling med kortikosteroid. Det vurderes derfor, at denne patientgruppe reagerer adækvat på vaccination med Zostavax®.
Opbevaring
Zostavax® er en levende svækket vaccine og er derfor meget temperaturfølsom. Vaccinen skal opbevares mellem 2 °C og 8 °C, og al håndtering udenfor køleskab skal minimeres. Vaccinen må aldrig fryse eller nå op på 25 °C. Vaccinen anbefales indgivet straks efter rekonstitution og under alle omstændigheder inden for 30 minutter. Går der længere tid, skal vaccinen kasseres.
Bestilling
Vaccinen er på lager fra uge 34 og kan bestilles fra den 1. september på elektronisk blanket 6 under SSI varenr. 69680 Helvedesild vaccine.
(P.H. Andersen, Afdeling for Infektionsepidemiologi, G. Germod, Sales and Business Development)
13. august 2014