Uge 39 - 2019
Vaccination med Tetravac i børnevaccinationsprogrammet
Forekomst af enterovirus D68
Vaccination med Tetravac i børnevaccinationsprogrammet
Som varslet i EPI-NYT 10/19 skal vaccinen Tetravac fra ultimo september 2019 anvendes som ny boostervaccine i børnevaccinationsprogrammet. Tetravac svarer til den hidtil anvendte boostervaccine DiTeKiPol Booster fra AJ Vaccines A/S (tidligere SSI vaccine).
Afregningskoder
Der sker ikke ændring i den normalt anvendte afregningskode, som fortsat er:
Di-Te-Ki-Pol-revaccination (vaccination gives 1 gang, normalt ved 5 år) = 8325
Overvågning af tilslutningen til vaccinationsprogrammet tager afsæt i den lovpligtige indberetning af vaccinationer til Det Danske Vaccinationsregister (DDV) via www.fmk-online.dk eller ved integration af DDV i det anvendte elektroniske journalsystem.
Om Tetravac
Tetravac er produceret af Sanofi Pasteur og godkendt af Det Europæiske Lægemiddelagentur (EMA). Tetravac beskytter mod fire sygdomme: difteri, tetanus, kighoste og polio. Antigenerne er adsorberet på 0,30 mg aluminiumhydroxid. Tetravac er identisk med Pentavac, dog med den undtagelse at Pentavac også indeholder en Hib-komponent, som blandes med DiTeKiPol-komponenten inden indgift.
Tetravac anvendes som boostervaccine til børn, som tidligere er vaccineret med grundvacciner i et primær program. Vaccinen gives sædvanligvis i 5-årsalderen, men gives den ikke på dette tidspunkt, kan vaccinen gives op til og med 17 år som en del af det almindelig børnevaccinationsprogram i Danmark. Varighed af beskyttelse mod difteri og tetanus vil i dette tilfælde være mindst 10 år, beskyttelsen mod kighoste forventeligt 5-10 år og beskyttelsen mod polio langvarig, formentlig livslang.
Tetravac er en såkaldt højdosis difterivaccine. Den kan derfor også anvendes som grundvaccine i de tilfælde, hvor det ikke er relevant at anvende HIB-komponenten. Hvis Tetravac anvendes som grundvaccine, skal der gives tre vacciner i grundprogrammet: 2 doser med mindst 2 måneders interval og en tredje dosis med et interval på mindst 6 måneder fra den senest givne vaccine. Herefter revaccineres efter 4 år.
Tetravac leveres i fyldt injektionssprøjte, som omrystes før brug for at opnå en homogen mælkehvid suspension. Tetravac gives ved intramuskulær injektion.
Bivirkninger
Bivirkningsmønstret ved Tetravac adskiller sig ikke væsentligt fra bivirkningsmønstret ved AJ vaccines’ boostervaccine. Meget almindelige (≥ 1/10) bivirkninger er lokal hævelse, smerte og rødme på injektionsstedet, utilpashed og feber ≥ 38 grader.
Anmeldelse af bivirkninger – skærpet indberetningspligt
Idet vaccinen ikke tidligere har været anvendt i det danske børnevaccinationsprogram, har Lægemiddelstyrelsen besluttet, at Tetravac underlægges skærpet indberetningspligt i forbindelse med introduktion i børnevaccinationsprogrammet. Skærpet indberetningspligt indebærer, at læger har pligt til at indberette alle formodede bivirkninger hos personer, som de har i behandling.
Alvorlige bivirkninger skal indberettes til Lægemiddelstyrelsen senest 15 dage efter, at lægen har fået formodning herom, og kan anmeldes via www.meldenbivirkning.dk.
Bestilling/levering
Tetravac kan bestilles via:
SSI varenr. 100117 Tetravac, 10x1 dosis.
Vaccinen kan bestilles via Blanket 6 eller ved henvendelse til Ordremodtagelsen, ordre@ssi.dk eller på telefon 3268 3111.
(P.H. Andersen, L.K. Knudsen, P. Valentiner-Branth, Afdeling for Infektionsepidemiologi og Forebyggelse, B. Neale, Forsyning)
Forekomst af enterovirus D68
Vi vil hermed minde om vigtigheden af indsendelse af enterovirus-positive prøvematerialer til den nationale overvågning af enterovirus på Statens Serum Institut (SSI). Vi anbefaler, at man indsender både positive fæces-, spinalvæske- og luftvejsprøver. Luftvejsprøver er især vigtige i forhold til detektion af enterovirus D68 (EV-D68), da denne virustype kun i meget få tilfælde er fundet i fæces eller spinalvæske.
Alle lande skal have en national overvågning af polio. I visse lande – heriblandt Danmark - er polioovervågningen udvidet med overvågning af alle typer enterovirus. Det vil sige, at når en patient bliver testet positiv for enterovirus, sender hospitalet prøverne til det danske WHO referencelaboratorium for poliovirus på Statens Serum Institut. SSI sørger for den videre analyse med blandt andet opformering i celler og sekventering, og vi kan dermed holde øje med, om der er særlig mange prøver med bestemte typer virus, om der er identificeret en ny type, eller om der er tale om, at virus ændrer sig. Blandt de danske patienter er feber og udslæt hyppige symptomer, men der er også flere tilfælde af meningitis, encephalitis og sepsis.
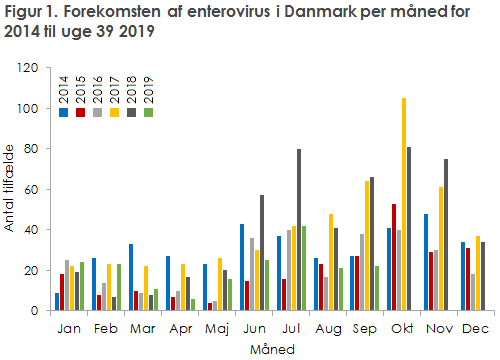
Sæsonen for enterovirus i Danmark er begyndt, og efter to år med forhøjet aktivitet, er sæson 2019 til og med september måned tilbage på et gennemsnitligt niveau, figur 1. 2017 og 2018 var begge præget af forhøjet forekomst af echovirus 30, men denne er nu tilbage på normalt niveau. Der er i august og september påvist EV-D68 hos tre patienter. EV-D68 forekommer normalt med to års mellemrum og forårsager hovedsageligt luftvejssymptomer, men kan i sjældne tilfælde forårsage en poliolignende sygdom – AFM/AFP (akut slap myelitis/akut slap parese), især hos børn over 5-årsalderen. Denne virustype forårsagede i 2014 et stort udbrud, der begyndte i USA og spredte sig videre til Europa, EPI-NYT 49/14. I 2014 var der mange tilfælde med AFM, især i USA, men også enkelte tilfælde i Europa. Der er fundet EV-D68 hos danske patienter i 2014, 2016, og 2018, og nu igen i 2019, men hidtil er der ikke rapporteret om AFM/AFP-tilfælde forårsaget af EV-D68 i Danmark.
Der er desuden identificeret ni tilfælde af enterovirus A71-infektion, med en subtype der tidligere i blandt andet Tyskland, Frankrig og Spanien har forårsaget tilfælde af rhomboencephalitis og encephalitis.
(S. E. Midgley, Virologisk Overvågning og Forskning, Afdeling for Mikrobiologisk Diagnostik og Virologi)